中药院内制剂转新药注册流程
中药院内制剂转新药注册流程
随着国家针对中药发布一系列利好政策,中药转内制剂也迎来了新的转折与创新,国家药品监督管理局(NMPA)等监管部门组织制定了《基于人用经验的中药复方制剂新药临床研发指导原则(试行)》等指导原则,此举推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,强调将中医药理论、“人用经验”和临床试验相结合,尊重传统中医药的临床实践规律。

药审中心的数据显示:2020-2024年中药新药IND和NDA申报均呈逐年上升的趋势。
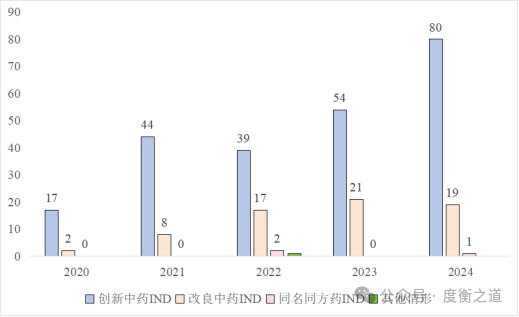
图1:2020—2024各注册类别中药IND情况
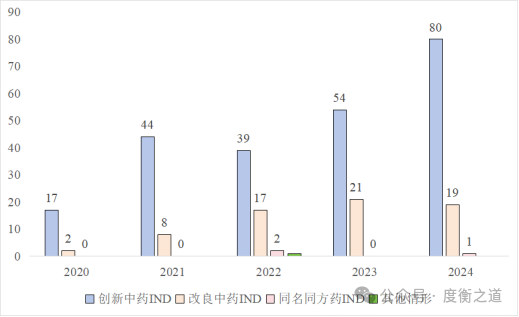
图2:2020—2024各注册类别中药NDA情况
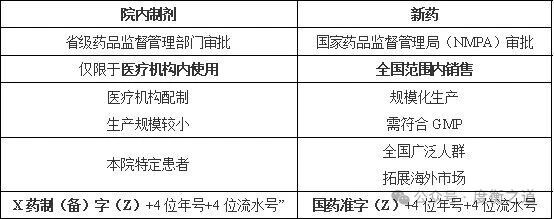
院内制剂研发
院内制剂与新药区别:
注:青海、四川、西藏、黑龙江、山东、北京参照21年数据
图3:全国各省份院内制剂统计
医疗制剂数量庞大,是中药新药的“摇篮”,按照“三结合”审评证据体系,具有高质量人用经验数据的院内制剂,可以豁免部分有效性实验和I、II期临床试验,直接进入III期临床试验,研发时间大大缩短。
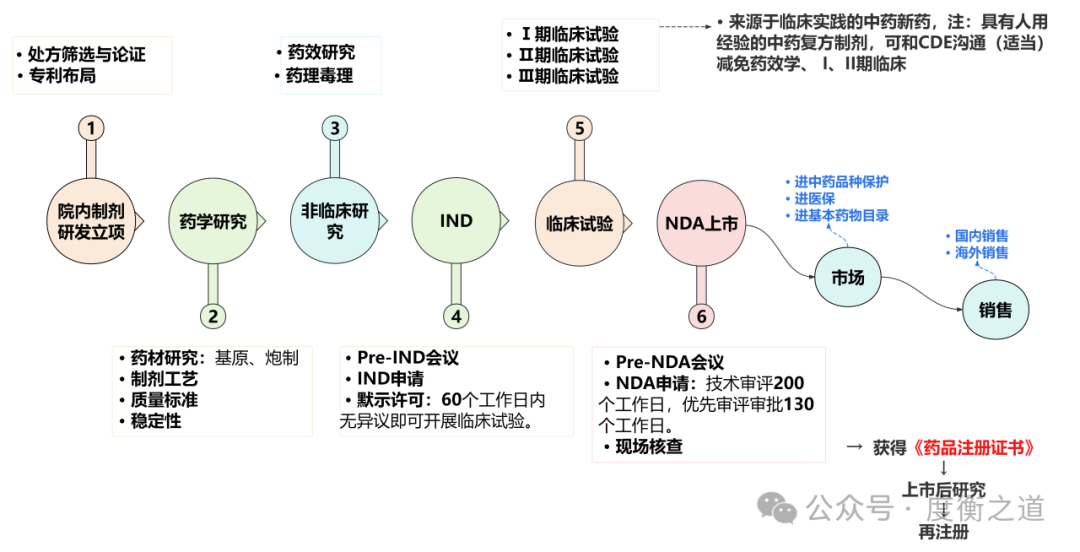
图4:院内制剂研发全生命周期
院内制剂研发过程中申请人可按照以下两个阶段提出沟通交流申请:①人用经验研究方案的沟通②人用经验数据的沟通
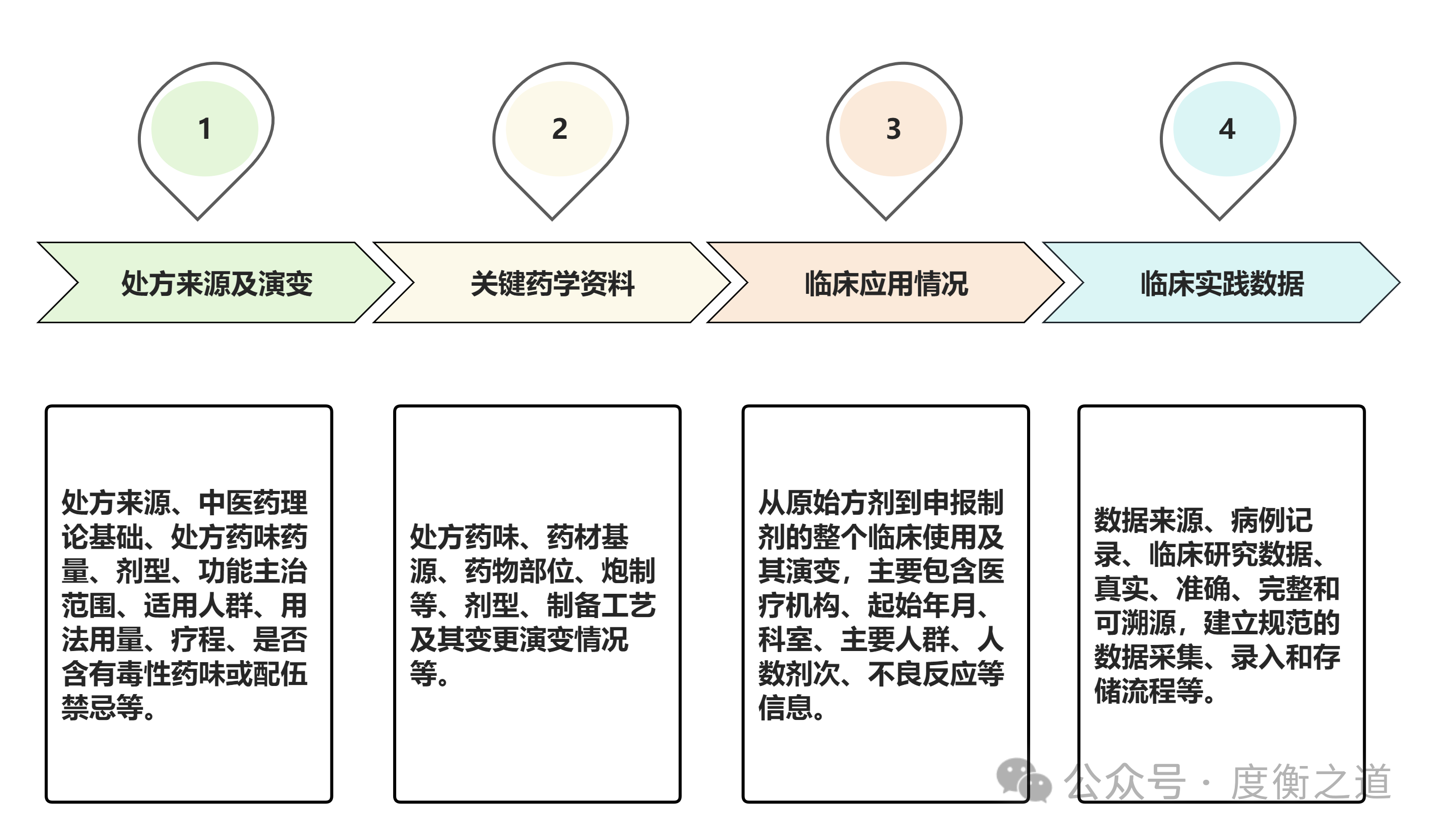 图5:院内制剂沟通交流CDE关注点
图5:院内制剂沟通交流CDE关注点
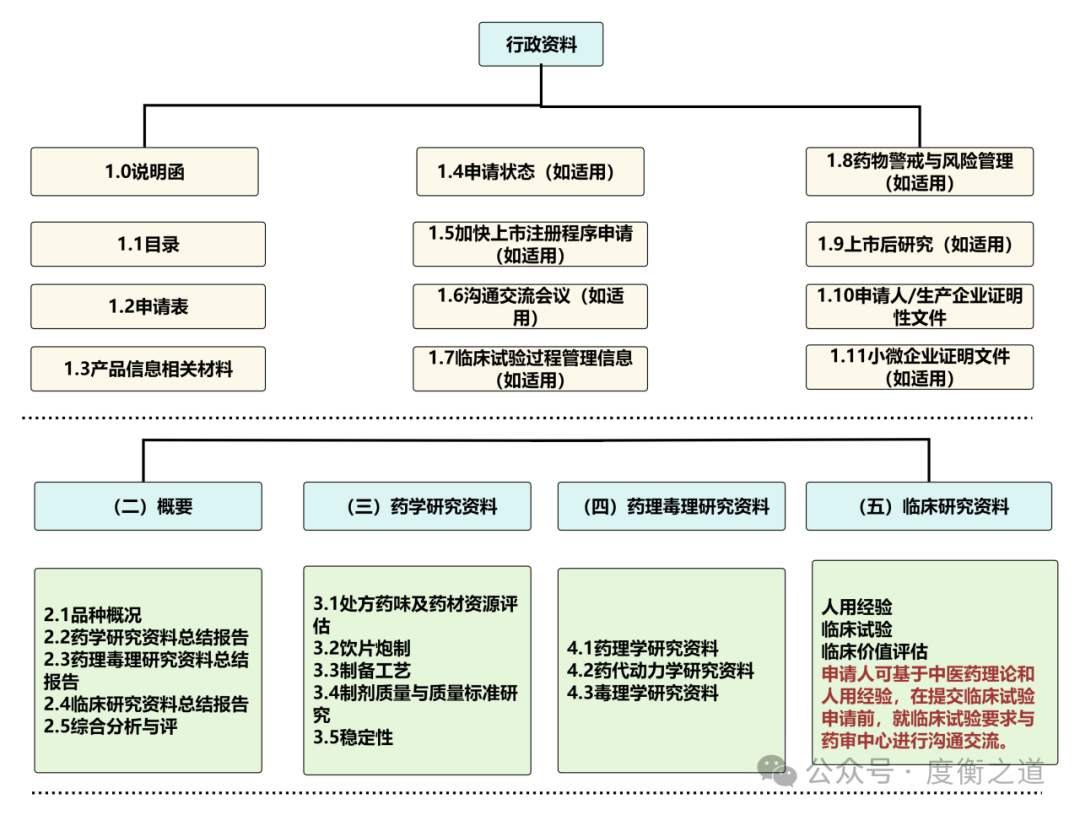
图6:院内制剂注册资料详情

图7;院内制剂药学研究内容
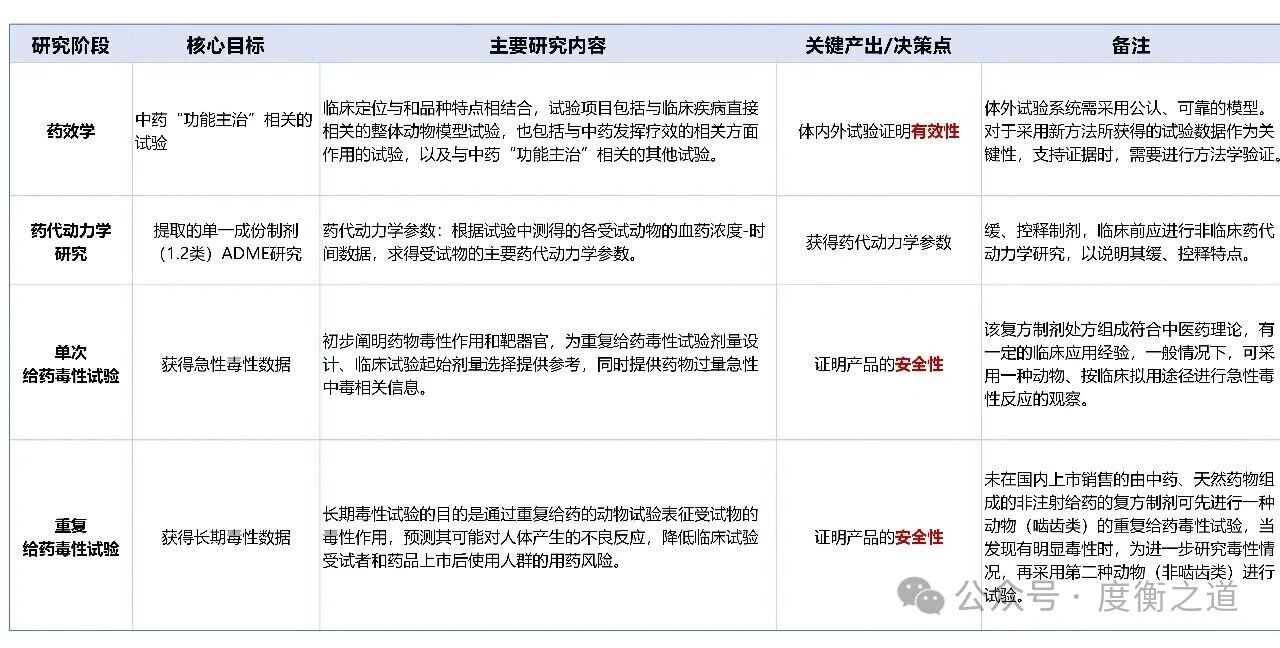
图8:院内制剂药理毒理研究内容
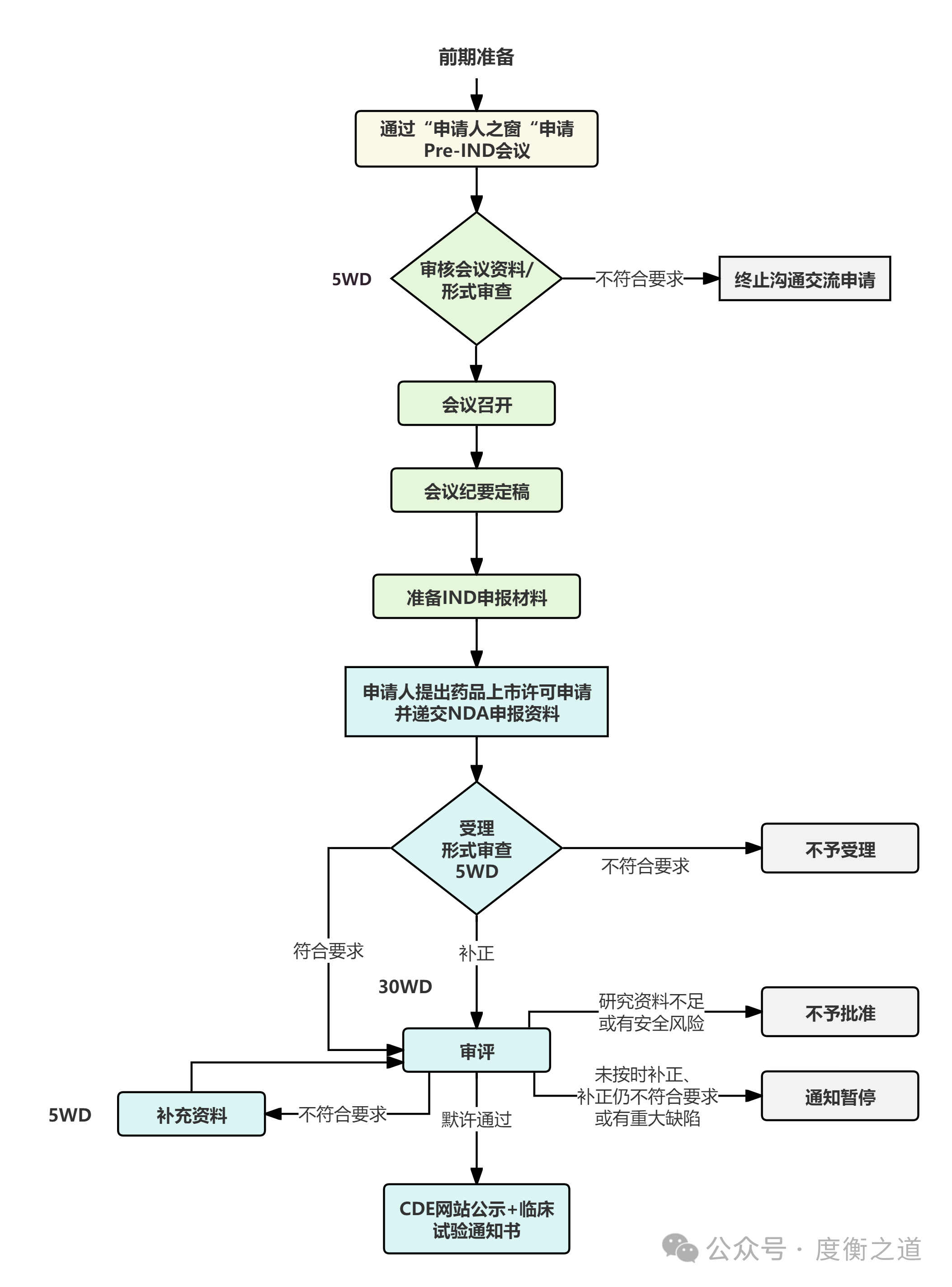
图9:IND申请流程
临床试验注意事项:
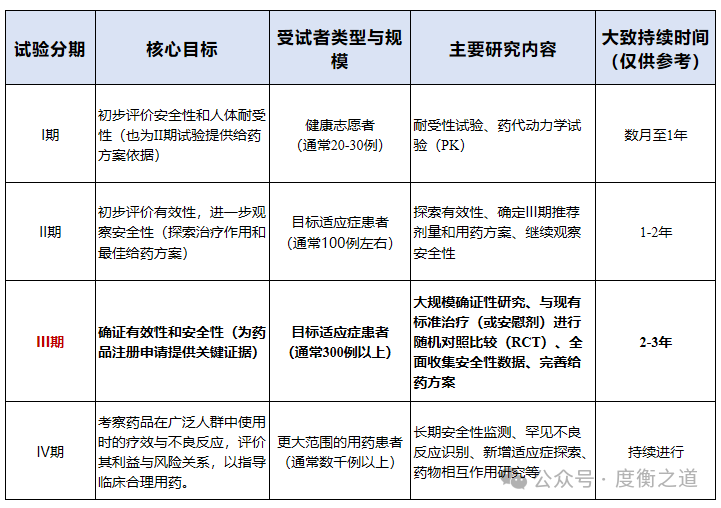
注:1.人用经验和Ⅱ期临床原则上只需开展1个;2.药学研究及非临床研究可以和人用经验同期开展
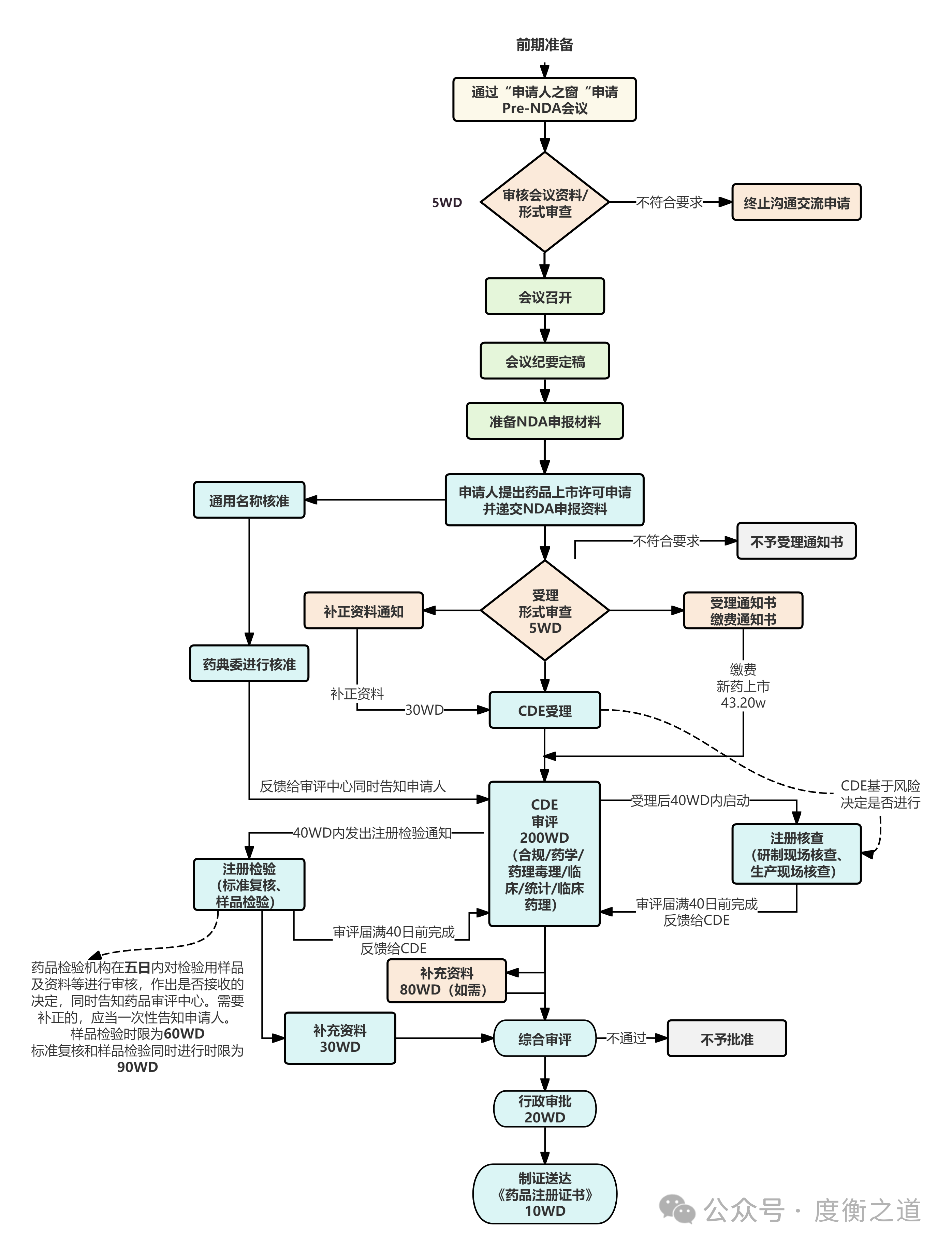
图10:NDA申请流程
医疗机构制剂向新药转化过程中,医院面临药学基础不充分,临床定位不精准;人用经验数据收集不规范,质量控制体系不明确;注册资料不全面等问题,这些均掣肘医疗制剂的转化。
度衡之道拥有专业的注册团队,助力精准选择项目、高效推进转化。在产品注册过程中,经验丰富的注册专家可以从法律规定、法规要求、技术符合和实操经验等更专业的角度分析并为申请人提供可行性建议,充分理解监管部门对产品申报资料的具体要求,精准地把握产品注册要点,多层次、多方面保持与客户、政府监管部门的双向有效沟通,保证项目的快速推进,助力院内制剂开发,缩短上市时间。
END

院内制剂转化联系人(微信同号):张乐:18301690034、刘佳:15941494721
