度衡之道凭借专业的技术服务团队、深厚的项目经验和广泛的行业资源,能够精准理解并贴合审评中心的审评尺度。我们严格把控申报资料的撰写质量,致力于为客户提供高效且成本优化的注册服务。助力企业顺利完成注册流程,助力产品快速上市。
服务项目
我们提供以下专业、全面的医疗器械/体外诊断试剂注册服务:
产品属性界定与分类界定:精准界定产品属性与分类,确保符合相关法规要求,对于分类不明的产品提供详尽的咨询与申报指导。
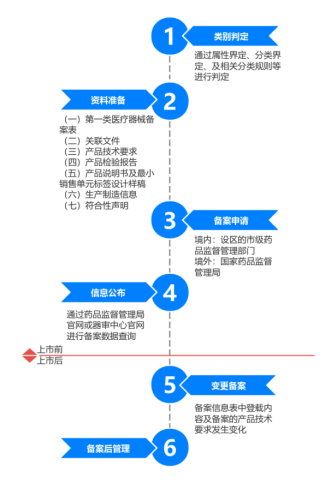
第一类医疗器械/体外诊断试剂备案:协助完成备案流程,确保产品合规上市。
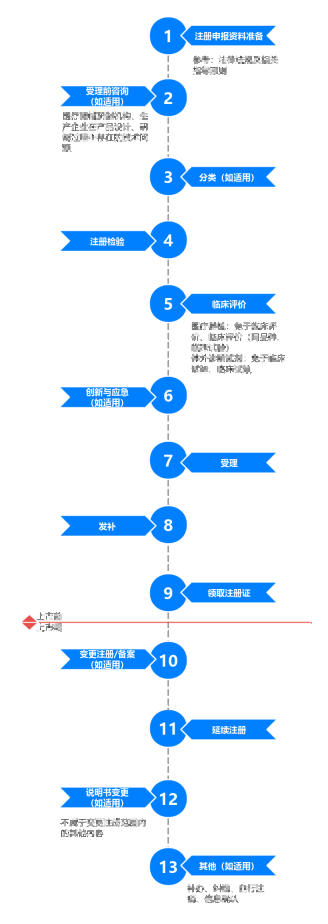
第二类/第三类医疗器械/体外诊断试剂首次注册:针对初次注册需求,提供全方位法规咨询与注册指导,助力产品顺利获批。
变更注册:针对产品变更需求,提供合规性评估与注册辅导,确保变更过程顺畅。
延续注册:为产品延续注册提供专业咨询与辅导,保障产品持续合规。
医疗器械/体外诊断试剂生产许可:指导企业完成生产许可申请,确保生产活动合法合规。
项目经验
我们凭借卓越的专业能力和丰富的实战经验,已成功协助多家企业取得医疗器械产品的注册证,包括但不限于:医美产品、睡眠呼吸监测系统、口腔科器械、眼科器械、医用康复设备、呼吸急救设备、临床检验产品、神经治疗设备、消毒灭菌设备、静脉内诊疗器械、可吸收止血材料、高频及射频治疗设备、诊断类医疗设备、医用成像系统、无源植入器械,以及与病原体(如抗原、抗体、核酸等)检测相关试剂等。我们致力于为企业提供全方位、高效率的注册辅导服务,助力企业快速、合规地推出高质量医疗产品。